Revista Iberoamericana de Neuropsicología
Vol. 4, No. 1: 58-70, enero-junio 2021.
Evaluación de síntomas psicológicos y conductuales en la demencia tipo Alzheimer. Estudio de revisión
Susana Lozano- Tovar, Msc.1 y Yaneth Rodríguez-Agudelo PhD.1
1 Departamento de neuropsicología. Instituto Nacional de Neurología y Neurocirugía MVS. Ciudad de México. México.
Autor Correspondiente:
Dra. Yaneth Rodríguez Agudelo
Instituto Nacional de Neurología
y Neurocirugía MVS. Ciudad de
México. México Insurgentes Sur
3877, Col. La Fama, Tlalpan,
C.P 14269. Tel: 525555287878
e-mail: yaneth_r@hotmail.com
Evaluación de síntomas psicológicos y conductuales en la demencia tipo Alzheimer. Estudio de revisión
Los Síntomas Psicológicos y Conductuales de la Demencia (SPCD) en la Demencia tipo Alzheimer (DA) se presentan en etapas tempranas e incluso preclínicas de la enfermedad. Para su exploración se debe realizar un abordaje clínico sistemático con criterios claros, además de complementar la valoración con escalas o inventarios válidos y confiables. No existe un estándar de oro para la evaluación de los SPCD ni una propuesta de su etiología. Por tal motivo, el objetivo del presente artículo fue realizar una revisión de la literatura reciente enfocándose en la descripción de los criterios diagnósticos utilizados actualmente para la DA, evaluación clínica de los SPCD en la DA e instrumentos más utilizados para su exploración, y revisar la reciente propuesta del estudio de variantes genéticas PER3 y OX2R como posibles causales de manifestaciones neuropsiquiátricas. Como resultado se realizó una descripción de los criterios DSM y NIA-AA para diagnóstico de DA, la descripción de tres escalas de SPCD siendo el Inventario Neuropsiquiátrico de Cummings el más utilizado para descripción de SPCD en DA, seguido por escala de Cornell para de depresión en demencia y la escala de apatía AES. Por último, se planteó la posible asociación entre los genes PER3 y OX2R y la presencia de algunos síntomas de SPCD como alteración del sueño y apetito. En conclusión, se evidenció que existen escalas válidas y útiles para la evaluación de SPCD, pero se debe tener conocimiento clínico de la utilización de esta; el estudio de variantes genéticas se plantea como una propuesta válida para el estudio de la etiología de los SPCD.
Palabras clave: demencia, SPCD, Alzheimer, trastornos neuropsiquiátricos, apatía, depresión genética.
The Psychological and Behavioral Symptoms of Dementia (SPCD) in Alzheimer’s type Dementia (AD) are present in early and even preclinical stages of the disease. For its exploration, a systematic clinical approach with a pellucid set of criteria must be carried out. In addition, to a complementary assessment with valid and reliable scales or inventories. There is no gold standard for the evaluation of SPCD or a proposal for its etiology. For these reasons, the objective of this article was to review the recent literature focusing on the description of currently used diagnostic criteria for AD, the clinical evaluation of SPCD in AD, the most commonly used instruments for its exploration, and the recent proposal of the study of genetic variants, such as PER3 and OX2R, as possible causes of neuropsychiatric manifestations. As a result, a description of the DSM and NIA-AA criteria for the diagnosis of AD was made, t the Cummings Neuropsychiatric Inventory was the most used scale for describing SPCD in AD, followed by the Cornell scale for depression in dementia, and the AES apathy scale. Finally, a hypothesis between a possible association between the PER3 and OX2R genes and the presence of some symptoms of SPCD such as sleep disturbance and appetite was formulated . In conclusion, it was evidenced that there are valid and useful scales for the evaluation of SPCD, but clinical knowledge of their usage are warranted, and the study of genetic variants is proposed as a valid proposal for the study of the etiology of SPCD.
La población mundial envejece y se prevé un aumento del 56% de las personas mayores de 60 años alrededor del mundo, especialmente en América Latina y el Caribe (1). Asociado al envejecimiento se encuentra la demencia, con estimaciones de 44 millones de personas que viven con esta enfermedad, siendo la más frecuente la demencia tipo Alzheimer (DA), que representa 50-70% de todos los casos diagnosticados a nivel mundial. Se calcula que para el 2050, existan 132 millones de personas con DA, con mayor aumento en los países de mediano y bajo ingreso de acuerdo con la ADI (Alzheimer´s Desease International, por sus siglas en inglés) (Tomado de https://www.alz.co.uk/) (2). El diagnóstico de la DA es clínico y principalmente se basa en el Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM, por sus siglas en inglés) en sus versiones IV-R y V (3), aunque también se han utilizado los criterios NIA-AA para demencia tipo Alzheimer (4).
El interés del estudio de la demencia y su evaluación clínica, especialmente la DA, no solo se relaciona con la alta prevalencia de esta patología alrededor del mundo, sino también con los Síntomas Psicológicos y Conductuales asociados a la Demencia (SPCD) que generalmente, suelen aparecer en etapas preclínicas de la enfermedad y son reportadas como las más desgastantes para la familia y el paciente (5). Es claro en la DA la presencia, desde etapas iniciales de la enfermedad, de síntomas de apatía y depresión como los SPCD con mayor prevalencia (5,6), sin excluir otros síntomas asociados que surgen durante la evolución de la enfermedad, como agresión e irritabilidad, comúnmente confundidos con enfermedades psiquiátricas (7) generando diagnósticos y tratamientos inadecuados. Actualmente, no existe un estándar de oro, que identifique con exactitud cada uno de los síntomas neuropsiquiátricos en la demencia tipo Alzheimer, aunque se han diseñado diferentes instrumentos o inventarios para describirlos, siendo los más utilizado según la literatura el Inventario neuropsiquiátrico de Cummings (NPI) (8), la Escala de Cornell para depresión en demencia (CSDD) (9) y la Escala de Evaluación de Apatía (AES) (10).
La evaluación de los SPCD ha sido principalmente clínica, basada en la observación, sin embargo, en la última década se ha nutrido de los avances en neurociencias, en especial de la genética, tratando de encontrar las causas del fenómeno clínico y postulando una mejor comprensión de la asociación entre variantes genéticas y trastornos psiquiátricos (11). Recientes investigaciones en neuro-genética han planteado varias hipótesis acerca de posibles asociaciones entre las demencias y patologías neuropsiquiátricas, facilitando el reconocimiento etiológico de manifestaciones psiquiátricas similares en patologías diferentes, por ejemplo la psicosis en esquizofrenia y la psicosis en la enfermedad de Alzheimer (11,12).
Algunos estudios se han enfocado en analizar diferentes genes, entre ellos PER3 y los genes asociados con las orexinas OX2R, y se han relacionado en forma importante con alteraciones del estado del ánimo, apetito y alteraciones en el sueño, síntomas comunes en los SPCD (13). Su exploración y análisis permitirá nuevos abordajes para el diagnóstico y tratamiento de los SPCD.
El objetivo del presente artículo fue realizar una revisión de la literatura reciente enfocándose en la descripción de los criterios diagnósticos utilizados actualmente para la DA, definición y evaluación clínica de los SPCD en la DA e instrumentos más utilizados para su exploración y revisar la reciente propuesta del estudio de variantes genéticas PER3 y OX2R como posibles causales de manifestaciones neuropsiquiátricas.
Se realizó una búsqueda de artículos indizados en las bases de datos de PubMed, ScienceDirect, PMC, Scielo desde 2010 hasta el 2020. Se utilizaron los términos “Síntomas Psicológicos y Conductuales de la Demencia”, SPCD, “Behavioral and Psychological Symptoms of Dementia”, “BPSD”, “neuropsychiatric symptoms of dementia”, “Depression AND Alzheimer´s disease”, Dementia, “Alzheimer´s disease”, “Cornell Scale for depression”, Neuropsychiatric Inventory (NPI), OX2R, PER3. La revisión se enfocó en estudios de pacientes con diagnóstico de demencia tipo Alzheimer y que reportaran al menos un SPCD o síntoma neuropsiquiátrico. También se buscaron meta- análisis y revisiones sistemáticas. Se revisaron publicaciones en idioma inglés y español. Se excluyeron estudios de caso.
Como resultado de la búsqueda bibliográfica se encontró que la mayor cantidad de estudios se asocian con NPI, depresión, seguido por apatía, pero se descartaron los que solamente describían cambios en los puntajes y no analizaban los síntomas para el diagnóstico de SPCD, ni describían las características de las escalas utilizadas. En cuanto a los artículos relacionados con genética solo se encontraron 7 que presentaran asociación con demencia tipo Alzheimer.
Para realizar la presente revisión bibliográfica se retoman 56 artículos publicados durante los últimos 10 años y las referencias de las escalas originales, con el fin de abordar los temas propuesto en el objetivo: Criterios actuales para el diagnóstico de la DA, definición y evaluación de los Síntomas Psicológicos y Conductuales en la DA, instrumentos frecuentemente utilizados para la exploración de los SPCD en la DA, y por último dar una breve descripción de la propuesta de las variantes genéticas PER3 y OX2R como posibles causales de alteraciones psiquiátricas.
Criterios Diagnósticos Para Demencia Tipo Alzheimer
El diagnóstico de DA es principalmente clínico y se realiza primariamente con el Manual de Diagnóstico y Estadístico de Trastornos Mentales, siendo las versiones más utilizadas en los estudios la versión del DSM IV y V (Diagnostic and Statistical Manual of Mental Disorders), por sus siglas en inglés (3). El DSM IV-R, establece como criterio principal la alteración en memoria episódica y en otra área cognitiva sumado a alteración en funcionalidad. El DSM V mantiene las características de pérdida de funcionalidad, deterioro cognitivo previo y cambia el concepto de demencia por Trastorno Neurocognitivo Mayor (TNM) como se describe a continuación (12):
Criterios diagnósticos propuestos en el DSM-V para Trastorno Neurocognitivo Mayor:
- Evidencia de un declive cognitivo sustancial desde un nivel previo de mayor desempeño en uno o más de los dominios cognitivos referidos: 1. Preocupación del individuo, de un tercero informado o del facultativo con respecto a un declive sustancial en las funciones cognitivas. 2. Declive en el desempeño neuropsicológico, implicando un desempeño en las pruebas del rango de dos o más desviaciones estándares por debajo de lo esperado en la evaluación neuropsicológica reglada o ante una evaluación clínica equivalente
- Los déficits cognitivos son suficientes para interferir con la independencia (requieren asistencia para las actividades instrumentales de la vida diaria, tareas complejas como manejo de medicación o dinero)
- Los déficits cognitivos no ocurren exclusivamente en el contexto de un delirium
- Los déficits cognitivos no son atribuibles de forma primaria a la presencia de otros trastornos mentales (trastorno depresivo mayor, esquizofrenia).
Adicionalmente, incluye subtipos etiológicos, de acuerdo con la clínica de la enfermedad, estableciendo así el diagnóstico de, por ejemplo, trastorno neurocognitivo mayor debido a la enfermedad de Alzheimer o trastorno neurocognitivo mayor vascular.
El DSM V ofrece una forma fácil para la clasificación de TNM, especialmente en la clínica. Sin embargo, resulta simple si se desea analizar otras variables que influyen en el pronóstico de la enfermedad como, por ejemplo, comorbilidad con patologías vasculares, muy frecuentes en Alzheimer, tampoco toma en cuenta el componente comportamental presente en la enfermedad, no existe un consenso en cuanto a la conceptualización de los SPCD.
Contrario es lo reportado por el grupo de McKhann en conjunto con el National Institute of Aging (NIA) y la Alzheimer’s Association (AA), quienes sí consideran las patologías comórbidas y el aspecto comportamental de los pacientes en un apartado para diagnóstico de demencia en general y demencia causada por enfermedad de Alzheimer (DA) en particular (4).
Los criterios NIA-AA para diagnóstico de demencia por enfermedad de Alzheimer, primero establecen la necesidad de hacer el diagnóstico de demencia teniendo en cuenta la lista de síntomas que se observan en la tabla I. Posteriormente, clasifican si es demencia por enfermedad de Alzheimer posible, probable o fisiopatológicamente comprobada.
Para el diagnóstico de DA probable se deben cumplir los criterios centrales o nucleares de demencia, además debe presentar inicio insidioso, empeoramiento cognitivo referido u observado y en función de los dominios cognitivos puede ser de predominio amnésico (típica) o no amnésico (atípica, con predominio de alteración en otra área cognitiva); además no debe existir patología cerebrovascular, de cuerpos de Lewy u otra patología neurológica o medicamentos que puedan alterar la cognición. La DA posible debe cumplir criterios nucleares y puede presentarse de forma atípica con perfil de Alzheimer, pero con inicio súbito o con insuficiente información de deterioro cognitivo, o también puede presentarse de forma mixta si hay evidencia del curso de una patología típica de Alzheimer concomitante con enfermedad vascular, cuerpos de Lewy u otra enfermedad neurológica que pueda tener efecto en la cognición. Los diagnósticos de probable o posible pueden estar acompañados con evidencia fisiopatológica y en este caso se añade al diagnóstico “con evidencia de proceso fisiopatológico”. Por último, la confirmación de la DA se realiza de forma fisiopatológica incluyendo los criterios clínicos descritos previamente (4).
Como se observa en los criterios tanto del DSM V y en los NIA-AA la capacidad cognitiva, evaluada a través de la evaluación neuropsicológica, es un elemento necesario para el diagnóstico del TNM o DA. Adicionalmente, el perfil neuropsicológico es un elemento esencial para el diagnóstico diferencial de cada demencia debido a las particularidades de compromiso cognitivo, ya que puede ser de tipo mnésico para el perfil típico o de compromiso en otro dominio para el diagnóstico atípico (14).
El perfil neuropsicológico típico de la DA se caracteriza por un inicio insidioso con compromiso en memoria y otra función cognitiva. La memoria es el primer dominio afectado, especialmente la memoria episódica, seguido por presencia de anomias y compromiso ejecutivo. En tanto la patología progresa, se evidencia mayor compromiso en las áreas descritas y deterioro en otras áreas como son las visuoespaciales y gnosias en estadios avanzados (14). La heterogeneidad de compromiso cognitivo en la enfermedad de Alzheimer es común por lo cual se ha descrito el perfil neuropsicológico atípico, en el cual la primera área en afectarse no es la memoria y se manifiesta, por ejemplo, con alteraciones visuoespaciales en la variante posterior o deterioro ejecutivo en la variante frontal (14,15).
Clínicamente, se evidencia que la DA es un continuo en el que las funciones cognitivas y funcionalidad se van perdiendo gradualmente, por lo cual se han establecido escalas como el CDR (Clinical Dementia Rating Scale) de Hughes (16), o el GDS (Global Deterioration Scale) de Reisberg (17), para describir el nivel de deterioro desde normal hasta demencia avanzada incluyendo progresión del bajo rendimiento en los dominios cognitivos por evaluación neuropsicológica, además de pérdida de funcionalidad instrumental y básica (18).
Definición de los Síntomas Psicológicos y Conductuales en la Demencia Tipo Alzheimer.
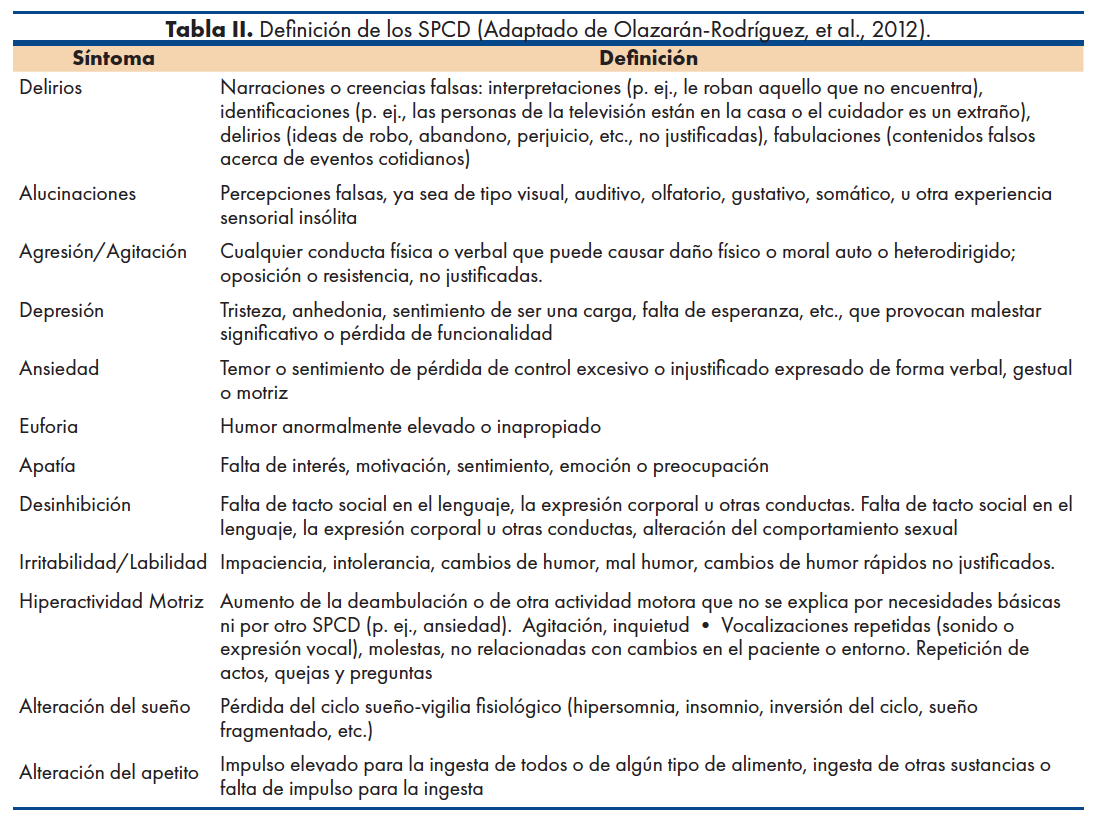
Los criterios NIA-AA, establecen la importancia de la sintomatología comportamental en la DA, y estos han sido estudiados como síntomas neuropsiquiátricos en la demencia. Sin embargo, debido a la variabilidad de dicha sintomatología comportamental en los pacientes, desde 1999 (12), se ha acuñado el término Síntomas Psicológicos y Conductuales de la Demencia (SPCD) (19), para englobar todo tipo de alteración en la conducta o síntomas neuropsiquiátricos y psicológicos que se presentan en los diferentes tipos de demencia. La tabla II muestra los principales SPCD reportados en la literatura (5,20,21).
Los SPCD se clasifican en dos categorías generales: La primera incluye síntomas psicológicos como delirios, alucinaciones, identificaciones erróneas, depresión, apatía y la ansiedad. La segunda incluye sintomatología conductual destacando alteración motriz/vagabundeo, agitación/agresión, resistencia a los cuidados, comportamientos sexuales inapropiados y reacciones catastróficas como enfado, agresividad verbal o física (22). Los SPCD aparecen en estadios iniciales e incluso preclínicos y se relaciona con mayor avance del deterioro de las personas con trastornos neurodegenerativos en comparación con las personas que no los presentan (23).
Los SPCD en DA son variados y dependen del estadio de la enfermedad, sin embargo, se ha determinado que la apatía es el síntoma principal desde etapas tempranas. Un meta análisis, en 2015, reporta a la apatía como síntoma principal con un rango entre el 19% y 88% (24), seguido por depresión, acompañado por síntomas como son ansiedad, agitación, irritabilidad y desinhibición en etapas moderadas y alteración motriz, delirios y alucinaciones en etapas más avanzadas (25). También se ha descrito una correlación entre aumento del puntaje del CDR y mayor frecuencia y severidad de los SPCD según la escala NPI, y asociación entre puntajes altos del CDR con mayor estrés en el cuidador de pacientes con DA (26).
Posteriormente Wolinsky et al., en 2018, reportan la distribución de los SPCD de acuerdo con su frecuencia de presentación de la siguiente forma: apatía (49%), depresión (42%), agresión/agitación (40%), ansiedad (39%), alteración del sueño (39%), irritabilidad (36%), alteración del apetito (34%), alteración motriz (32%), delirios (31%), desinhibición (17%), alucinación (16%) y euforia (7%), descritos en relación con los ítems del NPI (27) .
La apatía es el SPCD principal en la DA, aunque también un síntoma que ha sido frecuentemente subdiagnosticado ya que se solapa con alteraciones propias de la demencia frontotemporal. No obstante, se ha logrado identificar un perfil de apatía en DA que se caracteriza por mejor rendimiento en iniciación del comportamiento y menores puntajes globales en el NPI que en la demencia frontotemporal (28). Se sabe que la apatía en ocasiones es compleja de evaluar, ya que los pacientes presentan menor autoconciencia de su padecimiento, siendo necesaria la información fidedigna de cuidador y una evaluación clínica minuciosa del paciente para una adecuado diagnóstico y manejo (29).
Instrumentos de evaluación para los SPCD
El diagnóstico de los SPCD se realiza mediante la observación y la entrevista al paciente y al cuidador, con apoyo de instrumentos para su cuantificación. El primer instrumento desarrollado para ello fue el cuestionario NPI en su versión original de 10 ítems (8), que excluía, inicialmente alteración del apetito y el sueño. Posteriormente, como lo describe Cummings en 2020, se realizan nuevas versiones del NPI, las cuales abordan alteraciones del apetito, sueño, además de incluir la valoracion de la sobrecarga del cuidador. Actualmente se cuenta con varias versiones de dicho inventario: NPI-Q, utilizado para tamización; la NPI-NH (Nurse Home) usada en centros geriátricos; la NPI-C, permite al clínico participar en el puntaje de la escala. Todas las versiones han sido administradas a pacientes con DA, siendo confiables y robustas para el diagnóstico clínico de SPCD (30).
No solo se ha utilizado el NPI para evaluar SPCD en DA, la literatura reporta otras escalas y se han podido comparar entre sí. Con el objetivo de contrastar las escalas de evaluación de SPCD, Ismail et al., 2013 compara síntomas de agitación y psicosis en pacientes con demencia de acuerdo con el NPI, el NBRS (Neurobehavioral Rating Scale) y el BEHAVE-AD (Behavioral Pathology in Alzheimer Desease Rating Scale), concluyendo que cada escala tiene un punto de corte distinto, y cada una es sensible y específica para diferentes síntomas (31). Por otra parte, Olazarán- Rodríguez et al. (2012) establece que el NPI constituye la mejor herramienta para evaluar los SPCD para Enfermedad de Alzheimer ya que es más amplia que el BEHAVE-AD, ofrece mayor sensibilidad al cambio y es el inventario neuropsiquiátrico más utilizado en la literatura (20).
Como se menciona anteriormente, la depresión es uno de los síntomas más prevalentes en el la demencia tipo Alzheimer. Actualmente, para realizar el diagnóstico de la depresión se utilizan los criterios del DSM-IV e inventarios o cuestionarios para identificar síntomas de depresión en los pacientes, es importante mencionar que pocas escalas utilizadas para evaluar depresión en pacientes con DA están diseñadas específicamente para dichos pacientes, lo cual genera sesgos en el diagnóstico.
La Escala de Cornell para Depresión en Demencia (CSDD) (32,33) es una de las escalas de depresión específicas para evaluar la depresión en pacientes con demencia tipo Alzheimer, es de las más utilizadas, evalúa, a través de una entrevista semiestructurada, la percepción del familiar y del paciente sobre síntomas depresivos, siendo útil aún en etapas avanzadas de la enfermedad. Dado que dicha escala valora tanto la percepción del paciente como la del familiar, tiene la ventaja de ser más precisa y confiable respecto a los síntomas, pues los pacientes pueden dar información con poca veracidad, especialmente en las etapas avanzadas de la demencia (9). La escala CSDD, por ser de fácil aplicación es ampliamente utilizada en diferentes ámbitos como el hospitalario. Esta escala ha sido considerada altamente sensible para la detección de depresión con un punto de corte >8 (34). Según el estudio de seguimiento a dos años de Barca, et al., en 2017, cuyo objetivo era evaluar la presencia de depresión asociada a la progresión de DA, muestran que el 82% de los pacientes se mantienen estables en los puntajes de CSDD y 13.3% aumentan sus puntajes durante la evolución de la enfermedad. Igualmente estos autores reportan asociación positiva entre los puntajes más altos obtenidos por los pacientes en las escalas CSDD y mayor nivel de deterioro según el puntaje de la escala CDR (35).
La apatía es uno de los síntomas psicológicos presentes en la demencia tipo Alzheimer, desde estadios preclínicos del padecimiento. Una de las escalas más utilizadas para medir la apatía es la Escala de Evaluación de Apatía (AES, por sus siglas en ingles) y define el síntoma como la falta de motivación no atribuible a enfermedad, deterioro cognitivo o angustia emocional, constituida como una dimensión psicológica la cual incluye características del comportamiento, cognitivas y emocionales (10,36). La escala AES, consta de 18 ítems con puntaje mínimo de 0 y máximo de 72, cuantificando el nivel de apatía del paciente. Puede ser diligenciada por un informante, el clínico o por autoreporte. Según el estudio de Guercio et al., 2015 esta escala muestra puntajes diferenciales entre adultos mayores sanos, pacientes con deterioro cognitivo con riesgo de demencia tipo Alzheimer y pacientes con demencia tipo Alzheimer, siendo de mayor sensibilidad el reporte del clínico en el caso de los pacientes con deterioro cognitivo (37).
Radakovic et al., en 2015, realizan una revisión sistemática de las escalas utilizadas para evaluar apatía en varias enfermedades neurodegenerativas y reportan que la escala AES, en su versión clínica, muestra calidad metodológica, ausencia de sesgos y resultados generalizables, destacando la buena construcción del instrumento y la utilidad de la entrevista a los informantes. Dichos autores critican la utilización de la subescala de apatía del NPI, mencionando falencias en su validez debido a la falta de información que se puede obtener, por lo tanto no se recomienda para ser utilizada de forma aislada en la elaboración de un diagnóstico de apatía (38).
Como se menciona anteriormente, la evaluación de síntomas psicológicos y conductuales asociados a la demencia se caracterizan por basarse en criterios clínicos de manuales diagnósticos, entrevistas y aplicación de escalas por parte de especialistas. Sin embargo, cada vez más se busca el apoyo de los avances científicos en las neurociencias para describir y conocer la posible etiología asociación o superposición presente entre los SPCD y variables biológico-genéticas.
Variables genéticas asociadas a los SPCD
Diversos autores han descrito los SPCD principalmente desde la perspectiva clínica neuropsiquiátrica y neuropsicológica (5,12,31,39), pero existen pocas investigaciones acerca de los factores causales especialmente desde el punto de vista genético. Actualmente existen trabajos de investigación que han tratado de asociar polimorfismos genéticos con presencia de alteraciones del sueño, depresión o apatía, brindando información relevante para comprender los mecanismos genéticos subyacentes a estas patologías (40–42).
Se sabe que los ciclos circadianos están determinados genéticamente y regulan funciones críticas como el comportamiento, los niveles de hormonas, el ritmo cardiaco, la presión arterial, la temperatura del cuerpo y el metabolismo, preparando al organismo para responder a condiciones ambientales predecibles y al sueño. Por tal motivo, la alteración de estos ciclos se ha asociado con alteración de la salud física y mental (43,44).
En los mamíferos, el ciclo circadiano está regulado por el sistema nervioso central por estructuras hipotalámicas, en la región ventral del hipotálamo anterior en donde se encuentran los núcleos supraquiasmáticos y por núcleos en tejidos periféricos, instaurándose un circuito que regula la estabilidad del sueño, y su alteración se asocia con compromiso de varios órganos entre ellos el cerebro, por lo cual es común encontrar alteraciones de este tipo en patologías neurológicas como enfermedad de Parkinson, de Alzheimer y trastornos psiquiátricos (46,52). Duncan en 2019 menciona que un cambio temprano en los ciclos circadianos puede asociarse con mayor progresión del deterioro cognitivo en pacientes con DA (40).
El ciclo circadiano se encuentra regulado por genes específicos como son los CLOCK (por sus siglas en inglés circadian locomotor output cycles kaput) y las orexinas (42). Existen varios genes CLOCK, si bien el más investigado en humanos es el PERIOD 3 (PER3) que participa en la organización temporal orgánica y ha sido asociado con trastornos mentales como lo describen Liberman et al., en 2017, Garbazza et al., en 2018 y Carvalho et al., en 2019, quienes relacionan genes CLOCK con síntomas de depresión, predisposición a niveles altos de ansiedad y cambios en el estado de ánimo (43,45–47).
Estudios han reportado que el ciclo del sueño se encuentra alterado en pacientes con DA y se han descrito trastornos del dormir con presencia de somnolencia diurna, lo que constituye un factor de riesgo para deterioro en la demencia (49). Otros autores describen trastornos del sueño en pacientes con DA caracterizados por despertar nocturno, siestas diurnas y cambio de los ciclos habituales de sueño. Adicionalmente, la alteración de los ritmos circadianos del sueño se ha visto ligada a un mayor proceso de neurodegeneración y patologías psiquiátricas como la depresión o alteraciones de la ingesta alimentaria (50,51).
Davies et al., en 2015, hipotetiza que la somnolencia diurna, la pérdida del apetito y el incremento de la actividad nocturna, pueden estar asociadas a la alteración en la regulación de los receptores OX2R, en el hipocampo de los pacientes con DA (48,49). Musiek, et al., en 2016, también reporta asociación entre alteración de sueño en pacientes con DA y polimorfismos genéticos como los estudiados en el PER3 (50).
El gen OX2R, es otro de los genes estudiados en el ciclo circadiano y está asociado a los neurotransmisores orexinas o hipocretinas que son neurotransmisores peptídicos localizados en el hipotálamo y que participan en la regulación de variedad de funciones ya que reciben información de sistemas internos como el hormonal, neuronal y metabólico, encargándose de procesos fisiológicos como proceso de vigilia/sueño, ingesta de comida y apetito, gasto energético y refuerzo, drogadicción y procesos cognitivos; por lo tanto, la alteración en las orexinas, específicamente de sus receptores cerebrales como OX2R, se ha relacionado con disfunción de los procesos de los cuales se encargan (51,52). Es así como Fadel et al., en 2013, establece una relación entre la alteración en el apetito de pacientes con DA y las orexinas, pues el compromiso en la regulación hipotalámica se puede asociar con el compromiso del hipocampo presente en la DA (53).
De acuerdo con la revisión de la literatura sobre la evaluación de SPCD y DA, queda claro que en la actualidad el paradigma cognitivo se complementa de forma importante con el comportamental para realizar el diagnóstico clínico de las demencias (12). Los SPCD no son obviados en el diagnóstico de la DA y en los criterios NIA-AA, los cambios de personalidad o en el comportamentales son datos clave para el diagnóstico diferencial (4). Sin embargo, no existe un consenso en cuanto a la conceptualización de los SPCD en la literatura.
Respecto a las escalas utilizadas para describir y evaluar los SPCD son pocas, pero, han sido de gran utilidad para su diagnóstico, pues los SPCD son un amplio conjunto de síntomas complejos y variables que pueden pasar desapercibidos con facilidad por parte del clínico. Se hace énfasis en la adecuada evaluación de los SPCD mediante la observación y entrevista al paciente y al cuidador, en la importancia, por parte del clínico, del conocimiento amplio de cada uno de los síntomas, especialmente la apatía y la depresión por ser los de mayor frecuencia en pacientes con DA.
La escala más utilizada para evaluar los SPCD, tanto en la práctica clínica como en ensayos, es el inventario NPI, si bien se deben conocer todas sus versiones para aplicar la más adecuada de acuerdo al propósito de estudio o de investigación. En cuanto a las escalas de apatía, son pocas las que son válidas y adaptadas a la DA, siendo la AES el instrumento que cumple con dichas características y se reporta en la literatura como la escala más utilizada para valorar apatía en pacientes con DA. La escala de Cornell para depresión en demencia muestra características similares, ha sido aplicada en ámbitos clínicos y estudios longitudinales con pacientes con DA, siendo robusta psicométricamente y de fácil aplicación.
Los instrumentos de evaluación han sido de gran ayuda para identificar y realizar diagnósticos diferenciales entre SPCD y adultos mayores normales, así pues, escalas globales como el NPI o más específicas como la de Cornell con su alta especificidad y sensibilidad y la AES, constituyen un abanico de posibilidades para el clínico que le permiten ampliar su evaluación y desarrollar un delimitado diagnóstico del paciente con demencia.
Aunque las escalas se han desarrollado con altos estándares psicométricos, su validez disminuye si son aplicadas por personas con poca experiencia clínica, con falta de conocimiento de los SPCD y de las características de los instrumentos de evaluación, o si omiten en la entrevista clínica la información del cuidador. Como reporta Gurcio et al., 2015, quienes comparan el reporte del paciente, del cuidador y del clínico y observan disminución en la sensibilidad del AES si se aplica a un paciente y no se analizan los resultados del cuidador y clínico (37). Igualmente, en la aplicación de otras escalas (Cornell o NPI) se debe hacer con amplio y claro conocimiento de la sintomatología neuropsiquiátrica de los pacientes con demencia, que es solventado en parte por la entrevista semiestructurada de la escala de Cornell, pero ausente en el NPI.
En el presenta artículo se excluyeron algunas escalas de evaluación de los SPCD, reportadas en la literatura, pues el objetivo principal era describir las más utilizadas en DA, sin embargo, cabe mencionar que existen otras escalas como la entrevista y calificación de apatía de demencia para pacientes con DA (DAIR), Inventario de Apatía (AI) y la escala de evaluación frontal, útil para el diagnóstico diferencial con demencia frontotemporal, siendo medidas confiables y válidas para los SPCD (54,55).
El estudio de la influencia de variables genética en las patologías psiquiátricas y neurológicas es un campo que ha permitido la comprensión de mecanismos neurogenéticos y ha apoyado en el diagnóstico diferencial entre diversas enfermedades neuropsiquiátricas con síntomas similares. En cuanto a la propuesta de asociación de los genes OX2R y PER3 con la etiología de los SPCD, se encontró que existe escasa literatura acerca de estudios genéticos en SPCD.
Sin embargo, en el presente estudio se expusieron dos genes (PER3 y el OX2R) asociados a alteraciones en la regulación el organismo que también se presentan en los SPCD y que pueden ofrecer información para comprender con mayor claridad la nosología de los SPCD, no solamente describiéndolos como síntomas asociados.
En conclusión, es evidente la presencia de los SPCD en los pacientes con demencia, los clínicos cuentan con escalas de evaluación confiables y sensibles para el estudio de los SPCD. No obstante, es evidente la faltan de estudios que sugieran contribuciones genéticas en la sintomatología psiquiátrica, específicamente en la DA, que permitan realizar una reestructuración nosológica de los síntomas neuropsiquiátricos en los pacientes con demencia (55,56). En general, poco se ha investigado sobre los factores biológicos-genéticos que se asocian con la etiología de los SPCD, solamente son atribuidos al proceso neurodegenerativo propio de la enfermedad. El estudio de factores biológico-genéticos pueden ser determinantes para la mejor comprensión y descripción de los SPCD.
Finalmente, destacamos la gran importancia de evaluar adecuadamente los SPCD en la demencia, especialmente en la EA. Una exploración precisa de estos síntomas permitirá realizar diagnósticos diferenciales, identificar subgrupos de pacientes, reconocer con facilidad factores de riesgo asociados a conductas psicológica y psiquiátricas. Un adecuado diagnóstico de los SPCD redundará en mejores tratamientos y estrategias de intervención terapéutica que mejoren la calidad de vida de los pacientes y eviten la sobrecarga del cuidador.
- Gutiérrez M, María R, Carmen D, Peña G, Arlet P, Rojas R, et al. La enfermedad de Alzheimer y otras demencoas como problema nacional de salud. 2016. 154 p.
- Lane CA, Hardy J, Schott JM. Alzheimer’s disease. Eur J Neurol. 2018;25(1):59–70.
- Asociación-Americana-de-Psiquiatría. Manual Diagnóstico y Estadístico de los Trastornos Mentales DSM V. 4th ed. 2013.
- Mckhann GM, Knopman DS, Chertkow H, Hyman BT, Jack CRG, Kawas CH, et al. The diagnosis of dementia due to Alzheimer’s disease: Recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease NIH Public Access. Alzheimers Dement. 2011;7(3):263–9.
- Ismail Z, Smith EE, Geda Y, Sultzer D, Brodaty H, Smith G, et al. Neuropsychiatric symptoms as early manifestations of emergent dementia: Provisional diagnostic criteria for mild behavioral impairment. Alzheimer’s Dement. 2016;12(2):195–202.
- Santabárbara Serrano J, Sevil Pérez A, Olaya B, Gracia García P, López Antón R. Depresión tardía clínicamente relevante y riesgo de demencia: revisión sistemática y metaanálisis de estudios prospectivos de cohortes. Rev Neurol. 2019;68(12):493.
- Taragano FE, Allegri RF, Krupitzki H, Sarasola D, Serrano CM, Loñ L, et al. Mild behavioral impairment and risk of dementia. J Clin Psychiatry. 2009;70(4):584–592.
- Cummings JL, Mega M, Gray K, Rosenberg-Thompson S, Carusi DA GJ. The Neuropsychiatric Inventory: comprehensive assessment of psychopathology in dementia. Neurology. 1994;44(12):2308–14.
- Alexopoulos GS, Abrams RC, Young RC, Shamoian C. The Cornell scale for depression in dementia : Administration & Scoring guidelines. Biol Psychiatry. 1988;23(3):271–84.
- Marin R. Apathy: concept, syndrome, neural mechanisms, and treatment. Semin Clin Neuropsychiatry. 1996;1(4):304-314,.
- Anttila V, Bulik-Sullivan B, Finucane HK, Walters RK, Bras J, Duncan L, et al. Analysis of shared heritability in common disorders of the brain. Science (80- ). 2018;360(6395).
- López-Álvarez J, Agüera-Ortiz LF. Nuevos criterios diagnósticos de la demencia y la enfermedad de Alzheimer: una visión desde la psicogeriatría. Psicogeriatria. 2015;5(1):3–14.
- Valencia A MH, Cassiani M CA, Cardona O JC, Talero JV. El sistema orexinérgico/hipocretinérgico y su rol en los trastornos del sueño. Salud Uninorte. 2010;26(2):285–97.
- Baddeley AD, Kopelman MD, Wilson BA. The Handbook of Memory Disorders. Vol. 2, JOHN WILEY & SONS, LTD. Chichester; 2002.
- Kolb B, Whishaw IQ. Fundamentals of Human Neuropsychology. Seventh Ed. Worth Publishers; 2015. 787 p.
- Hughes CP, Berg L, Danziger WL, Coben LA, Martin RL. A new clinical scale for the staging of dementia. Br J Psychiatry. 1982;140(6):566–72.
- Reisberg B, Ferris SH, de Leon MJ, Crook T. The global deterioration scale for assessment of primary degenerative dementia. Am J Psychiatry. 1982;139:1136–9.
- Arvanitakis Z, Shah RC, Bennett DA. Diagnosis and Management of Dementia: Review. Jama. 2019;322(16):1589–99.
- Logiudice D, Watson R. Dementia in older people: An update. Intern Med J. 2014;44(11):1066–73.
- Olazarán-Rodríguez J, Agüera-Ortiz LF, Muñiz-Schwochert R. Síntomas psicológicos y conductuales de la demencia: Prevención, diagnóstico y tratamiento. Vol. 55, Revista de Neurologia. 2012. p. 598–608.
- Kolanowski A, Boltz M, Galik E, Gitlin LN, Kales HC, Resnick B, et al. Determinants of behavioral and psychological symptoms of dementia: A scoping review of the evidence. Nurs Outlook. 2017;65(5):515–29.
- Zheng Z, Wang J, Yi L, Yu H, Kong L, Cui W, et al. Correlation between behavioural and psychological symptoms of Alzheimer type dementia and plasma homocysteine concentration. Biomed Res Int. 2014;2014.
- Agüera-Ortiz LF, López-Álvarez J, Del Nido-Varo L, Soria García-Rosel E, Pérez-Martínez DA IZ. Deterioro comportamental leve como antecedente de la demencia: presentación de los criterios diagnósticos y de la versión española de la escala MBI-C para su valoración. Rev Neurol. 2017;65:327–34.
- Nobis L, Husain M. Apathy in Alzheimer’s disease. Current Opinion in Behavioral Sciences. 2018.
- Peters ME, Schwartz S, Han D, Rabins P V, Steinberg M, Tschanz JT, et al. Neuropsychiatric symptoms as predictors of progression to severe Alzheimer’s dementia and death: The cache county dementia progression study. Am J Psychiatry. 2015;172(5):460–5.
- Kazui H, Yoshiyama K, Kanemoto H, Suzuki Y, Sato S, Hashimoto M, et al. Differences of behavioral and psychological symptoms of dementia in disease severity in four major dementias. PLoS One. 2016;11(8):1–16.
- Wolinsky D, Drake K, Bostwick J. Diagnosis and Management of Neuropsychiatric Symptoms in Alzheimer’s Disease. Curr Psychiatry Rep. 2018;20(12).
- Quaranta D, Marra C, Rossi C, Gainotti G, Masullo C. Different Apathy Profile in Behavioral Variant of Frontotemporal Dementia and Alzheimer’s Disease: A Preliminary Investigation. Curr Gerontol Geriatr Res. 2012;2012.
- Jacus JP. Awareness, apathy, and depression in Alzheimer’s disease and mild cognitive impairment. Brain Behav. 2017;7(4).
- Cummings J. The Neuropsychiatric Inventory : Development and Applications. J Geriatr Psychiatry Neurol. 2020;33(2):73–84.
- Ismail Z, Emeremni CA, Houck PR, Mazumdar S, Rosen J, Rajji TK, et al. A comparison of the E-BEHAVE-AD, NBRS, and NPI in quantifying clinical improvement in the treatment of agitation and psychosis associated with dementia. Am J Geriatr Psychiatry. 2013;21(1):78–87.
- Luppa M, Sikorski C, Luck T, Ehreke L, Konnopka A, Wiese B, et al. Age- and gender-specific prevalence of depression in latest-life – Systematic review and meta-analysis. J Affect Disord. 2012;136(3):212–21.
- Morimoto SS, Kanellopoulos D, Manning KJ, Alexopoulos GS. Diagnosis and Treatment of Depression and Cognitive Impairment in Late-Life.
- Sajjad MU, Blennowb K, Knapskogd AB, Idlanda A-V, Chaudhry FA, Wyllere TB, et al. Cerebrospinal Fluid Levels of Interleukin-8 in Delirium, Dementia, and Cognitively Healthy Patients. J Alzheimer’s Dis xx. 2020;Pre-press:1–10.
- Barca ML, Persson K, Eldholm R, Benth JŠ, Kersten H, Knapskog AB, et al. Trajectories of depressive symptoms and their relationship to the progression of dementia. J Affect Disord. 2017;222:146–52.
- Marin R, Biedrzycki RC, Sekip F. Reliability and Validity of the Apathy Evaluation Scale. Psychiatry Res. 1991;38:143–62.
- Guercio BJ, Donovan NJ, Munro CE, Aghjayan SL, Wigman SE, Locascio JJ, et al. The Apathy Evaluation Scale: A Comparison of Subject, Informant, and Clinician Report in Cognitively Normal Elderly and Mild Cognitive Impairment. J Alzheimer’s Dis. 2015;47(2):421–32.
- Radakovic R, Harley C, Abrahams S, Starr JM. A systematic review of the validity and reliability of apathy scales in neurodegenerative conditions. Int Psychogeriatrics. 2015;27(6):903–23.
- Colombo D, Caltagirone C, Padovani A, Sorbi S, Spalletta G, Simoni L, et al. Gender Differences in Neuropsychiatric Symptoms in Mild to Moderate Alzheimer’s Disease Patients Undergoing Switch of Cholinesterase Inhibitors: A Post Hoc Analysis of the EVOLUTION Study. J Women’s Heal. 2018;27(11):1368–77.
- Duncan MJ. Interacting influences of aging and Alzheimer’s disease on circadian rhythms. Eur J Neurosci. 2019;0–2.
- Yesavage JA, Noda A, Hernandez B, Friedman L, Cheng JJ, Tinklenberg JR, et al. Circadian Clock Gene Polymorphisms and Sleep/Wake Disturbance in Alzheimer’s Disease the Alzheimer’s Disease Neuroimaging Initiative. Am J Geriatr Psychiatry. 2012;19(7):635–43.
- Logan RW, McClung CA. Rhythms of life: circadian disruption and brain disorders across the lifespan. Nat Rev Neurosci. 2019;20(1):49–65.
- Garbazza C, Benedetti F. Genetic factors affecting seasonality, mood, and the circadian clock. Front Endocrinol (Lausanne). 2018;9(AUG):1–9.
- Jagannath A, Taylor L, Wakaf Z, Vasudevan SR, Foster RG. The genetics of circadian rhythms, sleep and health. Hum Mol Genet. 2017;26(R2):R128–R138.
- Hickie IB, Naismith SL, Robillard R, Scott EM, Hermens DF. Manipulating the sleep-wake cycle and circadian rhythms to improve clinical management of major depression. BMC Med. 2013;11(1).
- Liberman AR, Kwon S Bin, Vu HT, Filipowicz A, Ay A, Ingram KK. Circadian Clock Model Supports Molecular Link between PER3 and Human Anxiety. Sci Rep. 2017;7(1):1–10.
- Carvalho F, Pedrazzoli M, Gasparin A, dos Santos F, Zortea M, Souza A, et al. PER3 variable number tandem repeat (VNTR) polymorphism modulates the circadian variation of the descending pain modulatory system in healthy subjects. Sci Rep. 2019;9(1):1–11.
- Davies J, Chen J, Pink R, Carter D, Saunders N, Sotiriadis G, et al. Orexin receptors exert a neuroprotective effect in Alzheimer’s disease (AD) via heterodimerization with GPR103. Sci Rep. 2015;5.
- Mendoza J. Food intake and addictive-like eating behaviors: Time to think about the circadian clock(s). Neurosci Biobehav Rev. 2019;106:122–32.
- Musiek E, Holtzman DM. Mechanisms Linking Circadian Clocks, Sleep, and Neurodegeneration. Science (80- ). 2016;354(6315):1004–8.
- Tanaka S. Transcriptional Regulation of the Hypocretin/Orexin Gene. In: Vitamins & Hormones. 2012. p. 70–95.
- Hernández-Rosas F, Santiago-García J. Ritmos circadianos, genes reloj y cáncer. Arch Med. 2010;6(2).
- Fadel JR, Jolivalt CG, Reagan LP. Food for thought: The role of appetitive peptides in age-related cognitive decline. 2013;
- Clarke DE, Ko JY, Kuhl EA, van Reekum R, Salvador R, Marin RS. Are the available apathy measures reliable and valid? A review of the psychometric evidence. Vol. 70, Journal of Psychosomatic Research. 2011. p. 73–97.
- Perri R, Monaco M, Fadda L, Caltagirone C, Carlesimo GA. Neuropsychological correlates of behavioral symptoms in alzheimer’s disease, frontal variant of frontotemporal, subcortical vascular, and lewy body dementias: A comparative study. J Alzheimer’s Dis. 2014;39(3):669–77.
- Sotomayor PA. Correlación entre la frecuencia de síntomas neuropsiquiátricos y de disfunción ejecutiva en pacientes con enfermedad de Alzheimer: Estudio exploratorio. Persona. 2007;0(010):125.