Revista Iberoamericana de Neuropsicología
Vol. 2, No. 2: 97-106, julio-diciembre 2019.
Evaluación del riesgo elevado de caídas en adultos mayores con deterioro cognitivo
Héctor G. Graviotto1, Marcos Sorbara1, Alexander Minond2, Gabriela Heinemann1, Patricia Martinez1, Celina Gagliardi1, Andrea Serra1, Florencia Ces Magliano1, María Martha Esnaola y Rojas1, Cecilia M. Serrano1,2,3
1 Neurología Cognitiva – Unidad Asistencial Dr. Cesar Milstein, Buenos Aires, Argentina
2 Carrera de Especialización en Neuropsicología Clínica, Facultad de Psicología, Universidad de Buenos Aires
3 Laboratorio de Investigación de la Memoria, Hospital Zubizarreta, Buenos Aires, Argentina
Correspondencia:
Cecilia M. Serrano, M.D, Ph.D.
Dirección: Emilio Mitre 688, CABA
CP1424
Teléfono: +541149011894
Correo: ceciliamserrano@yahoo.com.ar
Evaluación del riesgo elevado de caídas en adultos mayores con deterioro cognitivo
Objetivo: Analizar la asociación entre riesgo elevado de caídas, deterioro cognitivo, tipo de afectación neuropsicológica y antecedentes médico-farmacológicos. Método: Se analizan de manera retrospectiva 332 pacientes ambulatorios (edad media: 75 años, 66% mujeres) que consultan por olvidos al consultorio externo del Servicio de Neurología de un hospital en Buenos Aires, Argentina. Los pacientes fueron evaluados con una batería neuropsicológica y clasificados en demencia, deterioro cognitivo leve (DCL) y normales. Los pacientes fueron agrupados de acuerdo al patrón de alteración neuropsicológica en un perfil “ejecutivo-atencional” (alteración del Trail Making Test A y Trail Making Test B > -1,5DS) y en un perfil “mnésico-visuoconstructivo” (alteración del test del reloj y reconocimiento del Test de Signoret > -1,5DS). Se relevan los antecedentes y medicación habitual. El riesgo de caídas fue evaluado mediante el índice de riesgo de caídas de Downton. Se analizó la asociación entre el riesgo de caídas, con grado de deterioro cognitivo (DCL, demencia), el tipo de afectación neuropsicológica (perfil “ejecutivo-atencional” y “mnésico-visuoconstructivo”) y los antecedentes médico-farmacológicos de los pacientes. Resultados: El 11% presentó alto riesgo de caída (Downton >2), en cuanto a uso de fármacos, se observó el uso de antidepresivos en un 7,5% (25), hipnóticos en 22% (74), neurolépticos en 6% (19) y de 2 o más de estos fármacos en 6,6% (22). Se encontró asociación con alto riesgo de caídas en pacientes con neurolépticos (OR=3,24 p=0,04) y antidepresivos (OR=2,9 p=0,04) como medicación habitual, como aquellos con perfil de compromiso neuropsicológico “ejecutivo-atencional” (OR=3,7 p=0,04). Conclusiones: Los pacientes con compromiso ejecutivo-atencional y uso de neurolépticos o antidepresivos como medicación habitual presentan mayor riesgo de caídas según el índice de Downton.
Palabras clave: deterioro cognitivo, caídas, adultos mayores, demencia
Las caídas constituyen un problema mundial en la salud pública ya que representan la segunda causa de muerte por lesiones no intencionales, tomando mayor relevancia en personas de más de 65 años, correspondiendo la primera causa de mortalidad y discapacidad 1-2.
Dentro de los factores que aumentan el riesgo de sufrir caídas en pacientes mayores se ha caracterizado al deterioro cognitivo como uno de los principales causantes. Esta asociación tendría que ver con ciertos dominios cognitivos afectados. El estudio de los perfiles de deterioro cognitivo por medio de evaluaciones neuropsicológicas ha identificado una interesante asociación entre mayor riesgo de caídas y disminución de las habilidades ejecutivo-atencionales3. La atención, es una función dinámica impulsada por una percepción sensorial y por la necesidad de seleccionar un estímulo preferido para una acción en particular mientras se ignora lo innecesario y lo irrelevante. Uno de sus componentes, la atención dividida (AD), es decir, la capacidad para llevar a cabo más de una tarea al mismo tiempo o realizar tareas dobles es un elemento muy importante. Si los recursos atencionales tienen una capacidad limitada y si una tarea secundaria exige atención, o se ve reducida por la ingesta de psicofármacos, la realización de al menos una de las tareas puede deteriorarse cuando se realizan simultáneamente. Numerosos estudios han demostrado que los efectos de la AD son mayores entre las personas mayores que fallan y los pacientes con enfermedades neurológicas, tales como accidente cerebrovascular, Enfermedad de Alzheimer o Parkinson, en comparación con adultos mayores sanos.
La función ejecutiva (FE) se refiere a un conjunto de procesos cognitivos de orden superior que controlan, integran, organizan y mantienen otras habilidades cognitivas. Se pueden dividir en varios subdominios: planificación, resolución de problemas, integración sensorial, juicio y razonamiento, así como la capacidad de manipular la atención. La FE puede disminuir con el envejecimiento.
Los adultos mayores relativamente sanos que se cayeron al menos dos veces tuvieron peor rendimiento que los que no se cayeron en pruebas de FE y atención, con normal rendimiento en pruebas de memoria de largo plazo en ambos grupos. Estos resultados sugieren que la alteración de las FE podría aumentar el riesgo de caídas por la alteración de la planificación motora para las actividades diarias3.
Las personas mayores con reducción de la FE caminan más despacio, se caen más a menudo y tienen un peor rendimiento en tareas de movilidad complejas. Déficits en la FE probablemente disminuyen la capacidad de reclutar mecanismos compensatorios en respuesta a cambios asociados con la marcha y el equilibrio, contribuyen a las interrupciones de la marcha y el equilibrio, y aumentan el riesgo de caídas. Esto puede explicar por qué se piensa que las medidas de FE son buenas predictoras de caídas4,-5.
La investigación sobre los psicotrópicos como factores de riesgo para lesiones por caídas comenzó a finales de los años ochenta 6. Desde entonces, las revisiones han establecido el uso de psicotrópicos como un factor de riesgo para caídas7-8. En un estudio sueco, los antidepresivos fueron los psicotrópicos más relacionados con las lesiones por caídas (OR ajustado: 1.42; 95 IC: 1.38–1.45). También los antipsicóticos, pero menos hipnóticos y sedantes, se asociaron con lesiones por caídas. Además, la cantidad de fármacos psicotrópicos se asoció con un mayor riesgo de lesiones por caídas de una manera dosis dependiente9. Aunque esta asociación está descrita en varios estudios, recientemente en una cohorte de pacientes con demencia10 se han obtenido resultados que sugieren una mayor influencia de los factores sociodemográficos, la salud física y los factores ambientales en el riesgo de caídas en comparación con la gravedad de la demencia o su farmacoterapia (incluyendo los psicotrópicos). Por lo que la asociación entre riesgo de caídas y consumo de drogas psicotrópicas aún genera controversias.
La alta prevalencia de caídas, a pesar de la función motora relativamente intacta, destaca el concepto de que éstas a menudo no son sólo un problema motor 4-9. Por otro lado, varios estudios prospectivos han informado que personas con anormalidades ‘neurológicas’ de la marcha presentaban mayor riesgo de desarrollar deterioro cognitivo, ya que los problemas de la marcha podrían predecir el desarrollo de demencia 6 a 10 años antes12. Estos estudios han avalado la noción de que la marcha y la función cognitiva se encuentran conectadas, tal vez compartan redes neuronales comunes, sugiriendo que los cambios de la marcha podrían actuar como un biomarcador para el futuro desarrollo de demencia 13.
Los primeros estudios que relacionaron las caídas con la función cognitiva utilizaron el Mini Examen del Estado Mental (MMSE) y la memoria a largo plazo con resultados controvertidos, excepto la atención y las FE 4.
Dada la falta de estudios en nuestro medio, el objetivo de este trabajo ha sido analizar la asociación entre el riesgo elevado de caídas, el deterioro cognitivo, el tipo de afectación neuropsicológica y los antecedentes médico-farmacológicos de los pacientes.
El diseño del estudio es de carácter descriptivo observacional retrospectivo.
- Participantes:
- Se analizaron 332 pacientes ambulatorios evaluados en la sección de neurología cognitiva de un servicio de Neurología por quejas cognitivas. Se escluyeron aquellos pacientes analfabetos (≤3 años de educación), con alteraciones sensoriales importantes que afecten a la comunicación y a la toma de los test, y/o patologías médicas descompensadas. Materiales/instrumentos:
Los pacientes de esta muestra fueron evaluados con una batería neuropsicológica comprendida por los siguientes tests:
1) Batería de Memoria de Signoret14.
Evalúa distintos tipos de funciones mnésicas: memoria inmediata, memoria a largo plazo (después de un período de tiempo en el cual se realiza otra prueba cognitiva) y reconocimiento.
La batería de memoria de Signoret consta de dos partes: I) recuerdo inmediato y diferido de una historia: se le lee al sujeto una historia que debe recordar y repetir a) de forma inmediata y b) luego de una interferencia; II) aprendizaje serial: a) Aprendizaje serial de la lista: los sujetos luego de escuchar la lectura de la lista de 12 palabras por parte del examinador deben repetirla de forma inmediata. Este procedimiento se repite 3 veces: aprendizaje serial 1 AS1, AS2 y AS3; b) Recuerdo libre diferido de la lista: luego de un período de 10 minutos, durante el cual se realiza otra prueba cognitiva, se le solicita al sujeto recordar las 12 palabras aprendidas previamente; c) Recuerdo facilitado con clave semántica: para aquellas palabras a las cuales el sujeto no había podido acceder espontáneamente, se le brinda una facilitación semántica; d) Reconocimiento por elección múltiple: para aquellas palabras aún no recuperadas, se le ofrece al sujeto la posibilidad de elegir entre 4 palabras de la misma categoría.
2) Test de Denominación de Boston versión en español 15
El test de Boston tiene por función examinar los distintos componentes del lenguaje. La denominación, una de las partes de esta batería, evalúa la memoria semántica. Este tipo de memoria no se altera con el envejecimiento y se afecta precozmente en las demencias corticales. Consiste en 60 láminas, las mismas tienen objetos impresos (de mayor a menor frecuencia de uso) que el examinador señala al sujeto y le pide que diga los “nombres” de los mismos.
3) Test de Fluencia Verbal 16
La fluencia verbal se mide por medio de la cantidad de palabras que puede producir un sujeto durante un período de tiempo. Cuando la consigna es generar palabras pertenecientes a una categoría semántica específica, se está evaluando la fluencia semántica, mientras que la fluencia fonológica hace referencia a la producción de palabras que comienzan con una letra determinada.
4) Trail making test (Test del Trazo) 17,18
Este test de fácil administración tiene por objetivo evaluar la atención y la función ejecutiva. Consta de dos partes (A y B) en las cuales el sujeto debe trazar sobre una hoja de papel con números impresos y rodeados por un círculo (versión A), una línea continua uniendo de forma consecutiva (de menor a mayor) dichos números. La versión B, tiene, además de los números, letras y el sujeto debe trazar la línea de forma alternativa entre estas dos secuencias (las letras también en orden creciente alfabéticamente). La consigna para ambas versiones es conectar los círculos lo más rápidamente posible, sin levantar el lápiz del papel. El puntaje está en relación con la cantidad de tiempo invertido en realizar cada una de las pruebas.
5) Span de dígitos 19. Este es un subtest del test de inteligencia WAIS para adultos. Evalúa la capacidad atencional. Consiste en la repetición inmediata de series crecientes de números, en el mismo orden de presentación. Su realización cobra importancia dada la frecuencia de alteración atencional en cuadros psiquiátricos y confusionales, contrastando con la normalidad de la misma en las demencias.
6) Test del Reloj: 20
La alteración de la visuocontrucción es uno de los compromisos precoces en la enfermedad de Alzheimer. El test del reloj permite una rápida evaluación de la visuoconstrucción, de la planificación, de la función ejecutiva y de la transcodificación semántica. Consiste en pedirle al examinado que dibuje un reloj con todos sus números dentro y que luego marque un horario (p.ej. Las 4 menos 20). Este test es muy sensible en el diagnóstico de la enfermedad de Alzheimer.
7) Clasificación Clínica de Demencias 21
En la evaluación y seguimiento de un paciente con demencia es útil poder establecer el estadio evolutivo de la enfermedad. Para ello, existen diversas escalas que otorgan un valor estandarizado de acuerdo al grado de afectación funcional. En general, se intenta objetivar la valoración a fin de poder clasificar la demencia según los criterios clínicos clásicos: demencia leve, moderada o severa. La escala CDR establece cinco estadios posibles : 0 = normal; 0,5 = cuestionable; 1 = demencia leve; 2 = demencia moderada; 3 = demencia severa. La estimación se realiza en base al rendimiento del sujeto en seis modalidades de tipo cognitivo y funcional. Estas modalidades son: memoria, orientación, razonamiento, actividades sociolaborales, actividades recreativas (hobbies o pasatiempos) y cuidado personal. Se consideró una funcionalidad preservada en aquellos pacientes con un CDR igual a 0 o 0,5.
El riesgo de caídas se midió mediante la siguiente escala:
Escala de Downton22: utilizada para valorar riesgo de caídas en adultos mayores. Evalúa las caídas previas, los medicamentos (ninguno, diuréticos, antiparkinsonianos, hipotensores no diuréticos, antidepresivos), los déficits sensitivo-motores (ninguno, alteraciones auditivas, alteraciones visuales, déficits motores en miembros, secuelas motoras), el estado mental (orientado, confuso), la marcha (segura con ayuda, insegura con/sin ayuda, imposible) y la edad (< 65 años o > 65). Asigna un valor de 0 o 1 a cada ítem. Cuando el resultado de la escala es (>2), es decir, de tres o más puntos, se considera que el paciente tiene un alto riesgo de sufrir una caída.
- Procedimiento:
Se seleccionaron los pacientes que acudieron al consultorio externo del Servicio de Neurología del Hospital Dr. César Milstein en la Ciudad de Buenos Aires, Argentina, entre mayo del 2017 y julio del 2017 inclusive y que consultaban por quejas cognitivas. Estos fueron clasificados en demencia (pacientes con CDR mayor o igual a 1 y deterioro en más de un dominio por debajo de -1,5DS en las pruebas realizadas en la evaluación neuropsicológica), deterioro cognitivo leve (pacientes con CDR de 0,5 y deterioro en al menos un dominio por debajo de -1,5DS en las pruebas realizadas en la evaluación neuropsicológica) y normal (pacientes con CDR de 0 y ningún dominio por debajo de -1,5DS en las pruebas realizadas en la evaluación neuropsicológica).
Se definieron dos tipos de perfiles: un “perfil ejecutivo-atencional” (Trail Making A y Trail Making B > -1,5DS con pruebas de Memoria y Test del reloj con valores normales) y un “perfil mnésico-visuoconstructivo” (test del reloj y reconocimiento del Test de Signoret > -1,5DS con Test del Trazo con valores normales). Se definieron estos dos grupos bajo la hipótesis que las pruebas cronometradas del Test del Trazo implican la preservación de los circuitos fronto-subcorticales y podrían reflejar indirectamente la indemnidad de circuitos de la marcha y motores23-24, siendo esto de un valor crítico para el estudio de riesgo de caídas. La relación entre esta prueba neuropsicológica y dichos circuitos ha sido analizada en distintos estudios donde se halló una correlación entre una disminución del desempeño en el Trail Making Test y un menor volumen de corteza cerebral orbitofrontal y cingulo anterior. Otro estudio reciente25 señala la relación entre un pobre desempeño en el test del trazo cronometrado y adelgazamiento cortical frontal derecho y lóbulo temporal lateral. Se comparó este perfil con otro denominado “mnésico-visuoconstructivo” con afectación predominantemente neo-cortical post-rolándica26 ( temporo-parieto-occipital) que refleja la distribución anatomo-patológica característica de los pacientes con Demencia Tipo Alzheimer o en riesgo de conversión.
Se relevaron los antecedentes médicos y la medicación habitual. El riesgo de caídas fue evaluado mediante el índice de riesgo de caídas de Downton 22.
Por tratarse de un estudio retrospectivo, la toma del consentimiento informado a los sujetos no pudo realizarse, sin embargo, los autores del presente trabajo han salvaguardado los datos personales anonimizando los mismos. El trabajo clínico está sujeto a las Reglas de Buenas Prácticas Clínicas del ICH, la última revisión de las declaraciones de Helsinski 27(Asociación Declaración de Helsinski, 2013 y los principios de Ley 3301 de CABA sobre la Protección de Derechos de sujetos en Investigaciones en Salud, 2009 28.
- Análisis estadístico:
Los datos demográficos y antecedentes se presentan como medias, desviación estándar y frecuencias. Para determinar la relación entre las variables cualitativas se utilizó el estadístico chi cuadrado y para variables cuantitativas la t de Student.
Para el análisis de la asociación entre el alto riesgo de caídas y los factores de riesgo, se utilizó un modelo de regresión logística binaria bivariada inicialmente y posteriormente multivariante de la variable dependiente (Alto riesgo de caídas dado por una puntuación mayor a 2 puntos en la escala de Downton) y las variables independientes (uso de fármacos y perfiles neuropsicológicos) con un método de introducción en bloque. Para el análisis comparativo del puntaje en el instrumento de Downton entre los distintos subgrupos (demencia, deterioro cognitivo leve y normales) se empleó un test de Kruskal-Wallis. Se utilizó un nivel de significancia de 5% para rechazar la hipótesis nula y los datos fueron analizados con el software Epi Info versión 7.
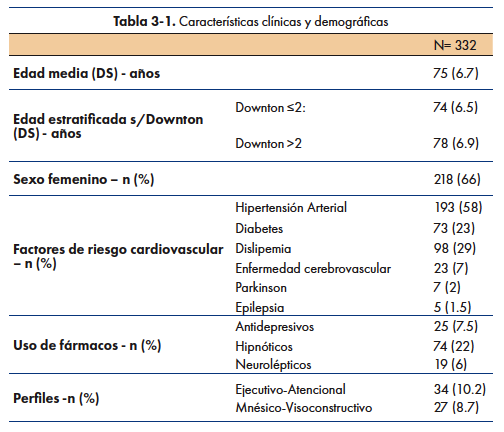
Un 66% de la muestra fueron mujeres, la edad media fue de 75 años (DS 6,7) y la media de escolaridad fue de 8.07 años (DS 3.8). Se categorizaron los pacientes que consultaron por olvidos en demencia=9,7% (32), deterioro cognitivo leve= 87% (289) y normales=0,2% (2).
La prevalencia de antecedentes neurológicos y factores de riesgo vasculares en esta muestra fueron: Accidentes cerebro vasculares =7% (23), Parkinson=2% (7), Epilepsia= 1,5% (5), Hipertensión Arterial=58% (193), Diabetes=22% (73), Dislipemia=29% (98).
Se encontró la presencia de antidepresivos en 7,5% (25), hipnóticos en 22% (74), neurolépticos en 6% (19), y presencia de 2 de estos fármacos en 6,6% (22).
36 pacientes (11%) presentaron un alto riesgo de caídas según el índice de riesgo de caídas de Downton 22.
En cuanto a los perfiles, 27 (8,7%) presentaron un perfil mnésico-visuoconstructivo y 34 (10,2%) un perfil ejecutivo-atencional. Ver Tabla 3-1.
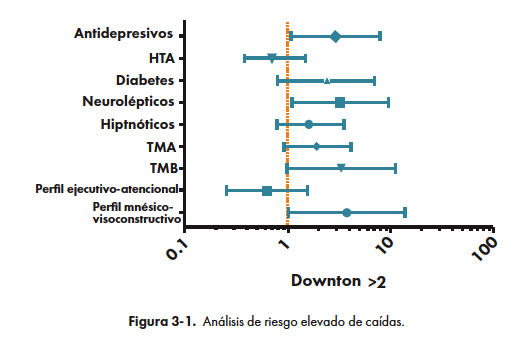
Comparando la puntuación de la escala de Downton mediante un análisis entre subgrupos (Normal, DCL y demencia) utilizando un test de Kruskal-Wallis, la distribución resultó la misma entre los distintos subgrupos (no hubo asociación entre un subgrupo y un valor mayor en la escala de Downton). Se analizó la asociación entre el aumento de riesgo de caídas y los perfiles cognitivos, encontrándose relación estadísticamente significativa con aquellos que presentan un perfil ejecutivo-atencional (OR= 3.7, p= 0.04). Adicionalmente, también se encontró una asociación entre el aumento de riesgo de caídas y el uso de neurolépticos (OR=3,24, p=0,04) o antidepresivos (OR=2,9 p=0,04).
Se analizó la correlación entre la edad y el puntaje en la escala de Downton mediante un coeficiente de correlación de Spearman que resultó rho= 0.166 (p= 0.001), lo cual se interpreta como una correlación positiva muy baja entre la edad y el puntaje en el instrumento.
No se determinó asociación estadísticamente significativa entre alto riesgo de caídas con antecedentes neurológicos y factores de riesgo vasculares (ACV, Parkinson, Epilepsia, HTA, Diabetes, Dislipemia), o drogas hipnóticas en esta población. Ver Figura 1.
En el presente estudio se analizan tres modelos (normales, DCL, DL) con caracterización de perfiles neuropsicológicos (perfil ejecutivo-atencional, perfil mnésico-visuoconstructivo) dentro del universo de consultas ambulatorias por olvidos realizadas en un Servicio de Neurología Cognitiva. Creemos que la dicotomización observada comúnmente en otros estudios, que se centran en la comparación de sólo dos modelos (presencia / ausencia de deterioro cognitivo), puede conducir a una notable pérdida de la eficiencia o incluso reducir el poder para encontrar las variables que se asocian con un riesgo elevado de caídas, especialmente cuando el deterioro cognitivo es el foco principal29. Por lo tanto, este enfoque puede ayudar a mejorar la estimación del riesgo en los distintos escenarios que se establecen en la consulta médica por queja cognitiva y permitir la identificación más precisa de los individuos con riesgo elevado de caídas y, por lo tanto, desarrollar estrategias de prevención.
En nuestra muestra encontramos que tanto la presencia de compromiso ejecutivo-atencional, como el uso de neurolépticos o antidepresivos son las variables que presentan riesgo elevado de caídas según el índice de Downton.
Con respecto a los hallazgos relacionados al tipo de perfil neuropsicológico afectado y el nivel de compromiso cognitivo, nos parece interesante comentar los siguientes puntos que a continuación desarrollaremos.
La relación entre la afectación de la memoria y el riesgo de caídas es un punto controvertido. Algunos autores sostienen que el déficit en la memoria inmediata puede ser el factor de riesgo más importante de caídas recurrentes30, tal vez por la incapacidad de elaborar estrategias de seguridad al no recordar lo previamente aprendido31. Sin embargo, en otros estudios en personas de edad avanzada, la memoria tiende a no ser un factor asociado con el riesgo de caídas32, lo que está en consonancia con los resultados de este estudio, donde la presencia de un perfil mnésico-visuoconstructivo no se asoció a un índice de Downton mayor a 2.
En cambio, el perfil ejecutivo-atencional que en nuestro trabajo se asocia con el riesgo elevado de caídas también ha sido reportado en otros estudios3-5,33, por lo que la evidencia es cada vez más fuerte de que estas pruebas cronometradas son buenos marcadores indirectos de la indemnidad o no de los circuitos fronto-estriatales de la marcha23-24.
En lo que refiere al alto riesgo de caídas en los distintos grados de deterioro cognitivo (DCL, demencia), no se encontró asociación estadísticamente significativa. Esto difiere de algunos trabajos que relacionan los puntajes más bajos en el MMSE con mayor riesgo34-35. No obstante, varios autores encuentran una relación no lineal entre el grado de deterioro cognitivo y el riesgo elevado de caídas36-38. Esto probablemente se deba a que el deterioro cognitivo afecta a los dominios de manera no uniforme39. Es por esto que pensamos que lo que impacta en el outcome estudiado es más bien el tipo de redes neuronales afectadas, siendo los circuitos ejecutivo-atencionales mejores marcadores predictores.
Con respecto al análisis de los antipsicóticos y antidepresivos, estos aumentan, al igual que en otros estudios7,8,9, el riesgo de caídas. Sin embargo, llama la atención que en esta muestra no se haya encontrado asociación con el uso de drogas hipnóticas. Una posible explicación podría ser que los hipnóticos y los sedantes se toman antes de acostarse y, por lo tanto, pueden ejercer su mayor influencia durante el sueño, mientras que las otras drogas psicotrópicas analizadas en este estudio se usan durante distintos momentos del día y, por lo tanto, pueden estar más relacionados con resultados adversos, como sedación excesiva y el consiguiente elevado riesgo de caídas9.
Dado que los psicotrópicos se usan ampliamente entre las personas mayores y el riesgo de que estos medicamentos se usen a largo plazo y/o con prescripción fuera de etiqueta9, es relevante revisar de manera dinámica la necesidad de continuidad de dichos tratamientos contemplando la relación riesgo-beneficio.
En relación a los antecedentes como la enfermedad cerebrovascular, la epilepsia o la Enfermedad de Parkinson, no podemos establecer asociaciones estadísticamente significativas, quizá ésta muestra presenta una n pequeña para poder sacar conclusiones válidas. Ahora bien, en el caso de los hipertensos, diabéticos y los dislipémicos, que son más prevalentes, tampoco se obtuvo asociación con el riesgo elevado de caídas y, aunque no podemos recabar el grado de control de dichos factores en cada individuo, podría ser razonable pensar que los avances en el tratamiento médico y la concientización en la población hayan tenido un efecto positivo en este sentido.
Consideramos que el presente estudio tiene algunas limitaciones propias al diseño retrospectivo que imposibilitaron la recolección de ciertos datos como, por ejemplo, el tiempo de evolución del deterioro cognitivo. Sin embargo, si pensamos en el mismo como un continuo, hemos analizado posibles asociaciones entre el DCL/demencia y Downton, como mencionamos previamente. Se observa la necesidad de futuros estudios prospectivos con registro de caídas que correlacionen los hallazgos con neuroimágenes funcionales.
En síntesis, la evaluación del adulto mayor debiera incluir una valoración del estado cognitivo, del riesgo de caídas y de la medicación concomitante entre otros.
Poder determinar problemas atencionales y ejecutivos en esta población podría permitir optimizar las intervenciones no farmacológicas para prevenir las caídas en los adultos mayores29. También consideramos relevante la implementación de instrumentos como el Downton en este tipo de población, ya que nos facilita la identificación de sujetos en riesgo particularmente alto de caídas, permitiéndonos enfocar el esfuerzo en corregir factores de riesgo potencialmente modificables como, por ejemplo, un uso cauteloso de fármacos neurolépticos o antidepresivos.
Declaración de intereses:
Los autores declaran no presentar conflictos de intereses.
Financiamiento:
Proyecto sin financiamiento.
Agradecimientos:
Los autores del trabajo agradecen a las neuropsicólogas del área Neurología cognitiva por los aportes para la presente investigación.
- Rubenstein LZ. Falls in older people: epidemiology, risk factors and strategies for prevention. Age Ageing. 2006; 35 (supply 2): ii37 – ii41.
- Kannus P , Sievanen H , Palvanen M , Jarvinen T , Parkkari J . Prevention of falls and consequent injuries in elderly people. Lancet. 2005; 366: 1885 – 1893
- Liu-Ambrose T, Ahamed Y, Graf P, Feldman F, Robinovitch SN. Older fallers with poor working memory overestimate their postural limits. Arch Phys Med Rehabil. 2008; 89:1335–1340.
- Orit Segev-Jacubovski, Talia Herman, Galit Yogev-Seligmann, Anat Mirelman, Nir Giladi, and Jeffrey M Hausdorff. The interplay between gait, falls and cognition: can cognitive therapy reduce fall risk?. Expert Rev Neurother. 2011 July; 11(7): 1057–1075.
- Herman T, Mirelman A, Giladi N, Schweiger A, Hausdorff JM. Executive Control Deficits as a Prodromal to fall in Healthy Older Adults: A Prospective Study Linking Thinking, Walking, and Falling. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. 2010; 65A (10):1086-1092.
- Campbell AJ. 1991. Drug treatment as a cause of falls in old age. a review of the offending agents. Drugs Aging 1: 289–302
- Bloch F, Thibaud M, Dugue B, et al. 2011. Psychotropic drugs and falls in the elderly people: updated literature review and meta‐analysis. J Aging Health 23: 329–346.
- Woolcott JC, Richardson KJ, Wiens MO, et al. 2009. Meta‐analysis of the impact of 9 medication classes on falls in elderly persons. Arch Intern Med 169: 1952–1960.
- Johnell K, Jonasdottir Bergman G, Fastbom J, Danielsson B, Borg N, Salmi P. Psychotropic drugs and the risk of fall injuries, hospitalisations and mortality among older adults. Int J Geriatr Psychiatry. 2017 Apr;32(4):414-420. Epub 2016 Apr 25.
- Van Der Wardt, V., Logan, P., Hood, V., Booth, V., Masud, T., & Harwood, R. (2015). The association of specific executive functions and falls risk in people with mild cognitive impairment and early-stage dementia. Dementia and Geriatric Cognitive Disorders, 40(3–4), 178–185.
- Van Iersel MB, Verbeek AL, Bloem BR, Munneke M, Esselink RA, Rikkert MG. Frail elderly patients with dementia go too fast. J Neurol Neurosurg Psychiatry. 2006; 77:874–876.
- Verghese J, Lipton RB, Hall CB, Kuslansky G, Katz MJ, Buschke H. Abnormality of gait as a predictor of non-Alzheimer’s dementia. N Engl J Med. 2002; 347:1761–1768.
- Alexander NB, Hausdorff JM. Linking thinking, walking, and falling. J Gerontol A Biol Sci Med Sci. 2008; 63:1325–1328
- Signoret JL, Whiteley A. Memory battery scale. Neuropsych.Soc.Bull 1979; 2-26.
- Allegri RF, Mangone CA, Rymberg S, Fernandez A, Taragano FE. Spanish version of the Boston naming Test in Buenos Aires. The Clinical Neuropsychologist (USA) 1997; 11, 4, 416-420.
- Benton AL, Hannay HJ, Varney NR, Spreen O. Contributions to neuropsychological assessment. New York: Oxford University Press, 1983.
- Reitan RM. Manual for administration of Neuropsychological Test Batteries for Adults and Children. Indianapolis University Medical Center. 1969
- Lezak MD (1995) Neuropsychological assessment, 3rd edn. New York: Oxford University Press.
- Wechsler D. Test de inteligencia para adultos (WAIS) Paidos, Buenos Aires, 1988.
- Freedman M, Leach L, Kaplan E, Winocur G, Shulman KL, Dellis D. Clock Drawing: A Neuropsychological Análisis. New York, NY Oxford University Press Inc, 1994.
- Hughes CD, Berg L, Danziger L, Coben LA, Martin RL. A new rating scale for the staging of dementia. Br J Psychiatry 1982; 140: 566-572.
- Downton JH. Falls in the Elderly. London: Edward Arnold, 1993.
- Hobert, M. A., Niebler, R., Meyer, S. I., Brockmann, K., Becker, C., Huber, H., … Maetzler, W. (2011). Poor trail making test performance is directly associated with altered dual task prioritization in the elderly – baseline results from the trend study. PLoS ONE, 6(11).
- Hobert, M. A., Meyer, S. I., Hasmann, S. E., Metzger, F. G., Suenkel, U., Eschweiler, G. W., … Maetzler, W. (2017). Gait is associated with cognitive flexibility: A dual-tasking study in healthy older people. Frontiers in Aging Neuroscience, 9(MAY), 1–9.
- MacPherson, S. E., Cox, S. R., Dickie, D. A., Karama, S., Starr, J. M., Evans, A. C., … Deary, I. J. (2017). Processing speed and the relationship between Trail Making Test-B performance, cortical thinning and white matter microstructure in older adults. Cortex, 95, 92–103.
- Matsuoka, T., Narumoto, J., Okamura, A., Taniguchi, S., Kato, Y., Shibata, K., … Fukui, K. (2013). Neural correlates o. The components o. The clock drawing test. International Psychogeriatrics, 25(8), 1317–1323.
- Declaración de Helsinki de la AMM -Principios éticos para las investigaciones
médicas en seres humanos. 64ª Asamblea General, Fortaleza, Brasil, 2013
- Ley 3301: sobre Protección de Derechos de Sujetos en Investigaciones en Salud, 2009.
- Muir, S. W., Gopaul, K. and Odasso, M. M. (2012). The role of cognitive impairment in fall risk among older adults: a systematic review and meta-analysis. Age and Ageing, 41, 299–308.
- Van Schoor, N. M., Smit, J. H., Pluijm, S. M., Jonker, C. and Lips, P. (2002). Different cognitive functions in relation to falls among older persons: immediate memory as an independent risk factor for falls. Journal of Clinical Epidemiology, 55, 855–862.
- Whitney, J., Close, J. C., Jackson, S. H. and Lord, S. R. (2012). Understanding risk of falls in people with cognitive impairment living in residential care. Journal of the American Medical Directors’ Association, 13, 535–540.
- Mirelman, A. et al. (2012). Executive function and falls in older adults: new findings from a five-year prospective study link fall risk to cognition. PLoSOne. 7, e40297.
- Chen, T. Y., Peronto, C. L. and Edwards, J. D. (2012). Cognitive function as a prospective predictor of falls. The Journals of Gerontology Series B: Psychological Sciences and Social Sciences, 67, 720–728.
- Ramirez, D., Wood, R. C., Becho, J., Owings, K., Markides, K. and Espino, D. V. (2010). Mini-mental state exam domains predict falls in an elderly population: follow-up from the hispanic established populations for epidemiologic studies of the elderly (H-EPESE) study. Ethnicity & Disease, 20, 48–52.
- Gleason, C. E., Gangnon, R. E., Fischer, B. L. and Mahoney, J. E. (2009). Increased risk for falling associated with subtle cognitive impairment: secondary analysis of a randomized clinical trial. Dementia and Geriatric Cognitive Disorders, 27, 557–563.
- Nazir, A., Mueller, C., Perkins, A. and Arling, G. (2012). Falls and nursing home residents with cognitive impairment: new insights into quality measures and interventions. Journal of the American Medical Directors’ Association, 13, 819.e1–6.
- Amar, K., Stack, E., Fitton, C., Ashburn, A. and Roberts, H. C. (2015). Fall frequency, predicting falls and participating in falls research: similarities among people with Parkinson’s disease with and without cognitive impairment. Parkinsonism & Related Disorders, 21, 55–60.
- Seijo-Martinez, M., Cancela, J. M., Ayán, C., Varela, S., & Vila, H. (2016). Influence of cognitive impairment on fall risk among elderly nursing home residents. International Psychogeriatrics, 28(12), 1975–1987.
- Martin, K. L. et al. (2013). Cognitive function modifies the effect of physiological function on the risk of multiple falls—a population-based study. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 68, 1091–1097.